Лекции по Концепциям Современного Естествознания (КСЕ)
Если Eкин движ≈Епотенц взаимод, то это жидкое состояние вещества.
Существуют четыре агрегатных состояния вещества. При переходы из одного состояния в другое могут наблюдаться фазовые переходы двух видов.
· Фазовые переходы первого (I) рода – когда в узком интервале температур скачком изменяется давление, плотность или объем.
· Фазовый переход второго (II) рода – это изменение порядка расположения атомов и молекул в кристаллических решетках. При таком переходе резко изменяется плотность. Например, превращение белого олова в серое при -14°С, и кристаллическая решетка из тетраэдров становится кубами.
Четвертое состояние вещества – плазма. Плазма – это ионизированный квазинейтральный газ, занимающий настолько большой объем, что в нем не происходит сколько-нибудь заметного нарушения нейтральности
Атом делится на электроны и положительные ионы. В зависимости от степени Ионизации газа различают:
1. Слабо ионизированную (низкотемпературную) плазму, α составляет доли процента, температура 1000-2000°С.
2. Умеренно ионизированную, α состоавляет несколько процентов, температура 5000-7000°С.
3. Сильно ионизированную (высокотемпературную), α=100%, температура 10000°С и выше.
Ионосфера представляет собой слабо ионизированную плазму. От нее отражаются радиоволны. В космическом пространстве плазма – это наиболее распространенное состояние вещества (все звезды, в которых идут термоядерные реакции, а таких большинство). В лабораторных условиях плазма образуется в различных формах газовых разрядов.
Основное применение молекулярно-кинетической теории:
1. Для разработки криогенной и вакуумной техники.
2. В космонавтике.
3. Исследование сверхпроводимости металлов.
4. Исследование нейтронных полей в ускорителях и ядерных реакторах (термоядерный синтез).
Основные законы классической (равновесной термодинамики).
Законы показывают переходы теплоты в работу. Изобретение паровых машин подтолкнуло развитие термодинамики. В 1848 году Джоуль впервые рассчитал эквивалент теплоты и работы 1 кал=4,187 Дж.
Термодинамическая система – это система, состоящая из большого числа частиц, взаимодействующих между собой. Термодинамические системы могут быть:
· Изолированными (замкнутыми) – это те системы, которые не сообщаются с окружающей средой ни работой, ни теплом, ни веществом, ни информацией. Другое название – равновесные.
· Открытые – сообщающиеся с окружающей средой. Открытые системы не изучаются классической термодинамикой.
Для замкнутых систем можно было применить наиболее простые расчётные уравнения, которые в некотором приближении подходили к описанию работы двигателей и тепловых машин. Параметры термодинамической системы: объем(V), работа(A), давление(P), температура(T), теплота(Q), внутренняя энергия тела(U).
Т является производной от энергии. Запас энергии всегда положителен, так как нельзя прекратить тепловое движение молекул, даже при Т=0 К остаются колебательные и вращательные движения.
Q – одна из форм энергии, определенное количество энергии, получаемое или передаваемое системой.
А определяется силой действия на систему. А=F·S, A=PΔV.
U включает в себя запас энергии атомов, молекул, электронов…
U=Uпоступ движ молек+Uядер+Ue+…
Без учёта Ек и Еп системы в целом!
Классическая термодинамика описывается тремя законами:
- Закон сохранения и превращения энергии.
Q=ΔU+A, где ΔU – изменение внутренней энергии.
Количество теплоты, сообщенное телу, идет на увеличение его внутренней энергии и совершение телом работы.
Q=ΔU+PΔV.
- Невозможно получить работу без затрат энергии, то есть, невозможен вечный двигатель первого рода. Универсальный закон природы, справедливый для живых и неживых объектов.
1 кг жира ® 38,9 кДж
1 кг углеводов ® 17,5 кДж
1 кг белков ® 17,5 кДж
Применение первого закона к изопроцессам.
- Изохорный, V=const. A=0, Q= ΔU
- Изобарный, P=const. Q=ΔU+PΔV
- Изотермический, T=const. ΔU=0, Q=A.
- Адиабатный (протекающие без теплообмена), чаще всего – это быстротекущие процессы. Q=const. A=-ΔU
10 лекция
Теплоёмкость ![]() - это количество теплоты, сообщенное телу и изменяющее при этом температуру тела на 1°С . Второй закон термодинамики рассматривает возможность и направление наблюдаемого процесса. Все самопроизвольные процессы идут в направлении выравнивания системы, и они всегда приводят к состоянию равновесия. Несамопроизвольный процесс идет только при воздействии извне.
- это количество теплоты, сообщенное телу и изменяющее при этом температуру тела на 1°С . Второй закон термодинамики рассматривает возможность и направление наблюдаемого процесса. Все самопроизвольные процессы идут в направлении выравнивания системы, и они всегда приводят к состоянию равновесия. Несамопроизвольный процесс идет только при воздействии извне.

Это реальный необратимый процесс.
Обратимый процесс – это когда при его завершении (возврате в исходное состояние) система самопроизвольно возвращается к этому состоянию без каких-либо потерь. Это гипотетический цикл. К обратимому циклу можно приблизиться, если сделать процесс бесконечно медленным. Все обратимые процессы равновесны. На основании обратимого цикла С. Карно в 1827 году разработал так называемый цикл Карно – цикл работающей тепловой машины. Рабочее тело в цикле Карно – идеальный газ, и при работе такого цикла в машине нет потерь на трение, лучеиспускание и т.п. Тепловая машина, или тепловой двигатель, - это такое устройство, которое превращает внутреннюю энергию топлива в механическую.
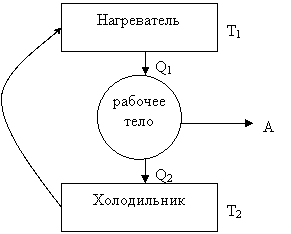
Рабочее тело (газ, пар) при расширении совершает работу, при этом получает от нагревателя теплоту Q1. Далее сжимается, при сжатии рабочее тело передаёт холодильнику теплоту Q2. (Q1<Q2, T2<T1).

1-2 – изотермическое расширение газа с температурой T1. При этом газ получает от нагревателя Q1.
Перейти на страницу: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25
