Кристаллы в природе
Природные кристаллы всегда возбуждали любопытство у людей. Их цвет, блеск и форма затрагивали человеческое чувство прекрасного, и люди украшали ими себя и жилище. С давних пор с кристаллами были связаны суеверия; как амулеты, они должны были не только ограждать своих владельцев от злых духов, но и наделять их сверхъестественными способностями. Позднее, когда те же самые минералы стали разрезать и полировать, как драгоценные камни, многие суеверия сохранились в талисманах «на счастье» и «своих камнях», соответствующих месяцу рождения. Все драгоценные природные камни, кроме опала, являются кристаллическими, и многие из них, такие, как алмаз, рубин, сапфир и изумруд, попадаются в виде прекрасно ограненных кристаллов. Украшения из кристаллов сейчас столь же популярны, как и во время неолита.
Одно из новых научно – технических направлений, сформировавшихся на наших глазах, - космическое материаловедение: получение новых веществ и материалов и улучшение их веществ в невесомости.
Наибольший интерес с точки зрения рентабельности производства в космосе представляют те вещества и материалы, к которым предъявляются повышенные требования в отношении их структурного совершенства и однородности.
Особое место среди них занимают монокристаллы полупроводников, получаемые обычно в наземных условиях кристаллизацией из расплавов в специальных высокотемпературных печах, после переплавка этих кристаллов осуществляется в условиях космоса.
Учеными обсуждалась ситуация кристаллизация звезд называемых белыми карликами. Теория эволюции звезд предсказывает, что когда белый карлик был молодым, в его недрах шли ядерные реакции, и он был довольно – таки горячим. После того как ядерные реакции кончились, температура в звезде могла быть еще около 107 К, при достаточно высоких температурах карлик мог и не быть кристаллическим. По мере его остывания должна пройти кристаллизация. В кристаллизующейся звезде внутренние области все время остаются горячее наружных, поэтому кристаллическая структура – «корка» - возникает сначала именно снаружи, а уже потом «прорастает» в глубь карлика. При кристаллизации выделяется энергия.
Тепловые и механические свойства твёрдых тел
I. Симметрия кристаллов
1.1 Как растут кристаллы.
Крупные одиночные кристаллы, имеющие свою правильную форму, в природе встречаются очень редко. Но такой кристалл можно вырастить в искусственных условиях.
Кристаллизация может происходить из раствора, расплава, а также из газообразного состояния вещества.
Рассмотрим кристаллизацию из расплава.
Для того чтобы вырастить один монокристалл, применяется следующий способ. Тигель с расплавом медленно опускается сквозь отверстие в вертикальной трубчатой печи. Кристалл зарождается на дне тигеля, так как оно раньше попадает в область более низких температур, а затем постепенно разрастается по всему объёму расплава. Дно тигеля специально делают узким, заострённым на конус, чтобы в нём мог расположиться только один кристаллический зародыш (рис.1).
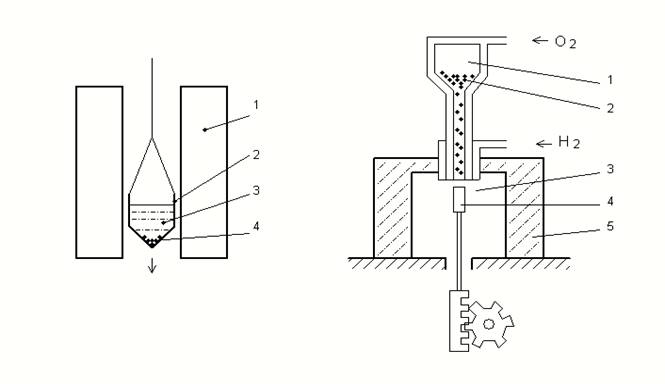
рис. 1 рис. 2
Этот способ часто применяется для выращивания кристаллов цинка, серебра, алюминия, меди и других металлов, а также хлористого натрия, бромистого калия, фтористого лития и других солей. За сутки можно вырастить кристалл каменной соли массой порядка килограмма.
Второй способ: Тончайший порошок окиси алюминия из зёрен размером 2-100 мкм высыпается тонкой струёй из бункера, проходит через кислородно-водородное пламя, плавится и в виде капель попадает на стержень из тугоплавкого материала. Температура стержня поддерживается несколько ниже температуры (2030). Капли окиси алюминия охлаждаются на нём и образуют корку спекшейся массы корунда. Часовой механизм медленно (10-20мм/ч) опускает стержень, и на нём постепенно вырастает неогранённый кристалл корунда (рис 2).
Теперь рассмотрим кристаллизацию из раствора.
В данном объёме той или иной жидкости при постоянной температуре и давлении может раствориться не больше определённого количества того или иного кристаллического вещества. Полученный при этом раствор называют насыщенным. Кристалл, помещённый в насыщенный раствор, не будет ни расти, ни растворяться в нём. Если повысить температуру жидкости, то растворимость её повышается, поэтому имеющееся количество растворённого вещества уже не будет насыщать раствор. Кристалл, помещённый в ненасыщенный раствор, начнёт в нём растворяться. Если насыщенный раствор охладить, он станет пересыщенным. Пересыщенные растворы могут сохраняться в замкнутых сосудах долгое время, не кристаллизуясь. Однако достаточно попасть в раствор малейшей частицы кристалла, как раствор немедленно начнёт кристаллизоваться.
Таким образом, пересыщение раствора является необходимым, но достаточным условием для кристаллизации. Чтобы кристаллизация началась, нужно внести в раствор затравку - небольшой кристалл растворённого вещества.
Из раствора кристалл выращивают обычно таким образом.
Вначале в воде растворяют достаточное количество кристаллического вещества. При этом раствор подогревают до тех пор, пока вещество полностью не растворится. Затем раствор медленно охлаждают, переводя его тем самым в пересыщенное состояние. В пересыщенный раствор подмешивают затравку.
Если, в течение всего времени кристаллизации, поддерживать температуру и плотность раствора одинаковыми во всём объёме, то в процессе роста кристалл примет правильную форму.
Сделаем опыт:
Закипятим 400г. воды и растворим в ней 400г. медного купороса. Горячий раствор отфильтровываем через ватку. И раствор остывает до комнатной температуры. В это время на проволоку наматываем нитку и приклеиваем маленький кристаллик. И опускаем нашу фигурку в пересыщенный раствор. Через сутки мы видим, что наша фигурка облеплена кристалликами.
Сделаем такой же раствор только из соли: 1 кг соли на 500л воды и опустим полиэтиленовую ёлку. Увидим, что вся ёлка похожа на осыпанную снегом ель.
Перейти на страницу: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29
